Teori regangan Baeyer” (Baeyer’s strain theory).
Menurut teori ini, senyawa siklik seperti halnya sikloalkana membentuk cincin
datar. Bila sudut-sudut ikatan dalam senyawa siklik menyimpang dari sudut
ikatan tetrahedral (109,50) maka molekulnya mengalami Regangan. Regangan ruang adalah besarnya regangan pada struktur
senyawa kimia berbentuk siklik untuk menunjukkan seberapa besarnya regangan
ruang dari cicin siklik tersebut. Dimana tabel data mengenai regangan ruang
dapat dilihat pada tabel berikut :
Sikloalkana
adalah golongan senyawa hidrokarbon jenuh yang rantai atom-atom
karbon-karbonnya tertutup (membentuk cincin), sehingga termasuk hidrokarbon
siklik. Karena sifat-sifat sikloalkana sangat mirip dengan golongan alkana
(hidrokarbon alifatik), maka sikloalkana dikategorikan sebagai hidrokarbon alisiklik.
Rumus umum sikloalkana CnH2n.
Dalam
pemberian nama sikloalkana selalu digunakan awalan siklo-. Sebagai contoh, sikloalkana
yang mengandung 3 atom C dinamakan siklopropana, yang mengandung 4 atom C
dinamakan siklobutana, dan seterusnya. Pada sikloalkana yang mengandung
substituen, pemberian namanya adalah dengan terlebih dahulu menyebut nama
substituen tersebut, diikuti dengan nama sikloalkananya. Sebagai contoh,
siklopentana yang mengandung sebuah substituen metil diberi nama
metilsiklopentana. Bila substituennya lebih dari sebuah diperlukan penomoran
dan dengan memperhatikan urutan alfabetik huruf pertama masing-masing
substituen. Sebagai contoh, 1,4-dimetilsikloheksana,
4-etil-1-metilsikloheksana, dan 1-tersierbutil-4-metilsikloheksana.
Kestabilan
(ketidakreaktifan) sikloalkana pada mulanya dijelaskan dengan “teori regangan
Baeyer” (Baeyer’s strain theory). Menurut teori ini, senyawa siklik seperti
halnya sikloalkana membentuk cincin datar. Bila sudut-sudut ikatan dalam
senyawa siklik menyimpang dari sudut ikatan tetrahedral (109,50)
maka molekulnya mengalami regangan. Makin besar penyimpangannya terhadap sudut
ikatan tetrahedral, molekulnya makin regang, dan berakibat molekul tersebut
makin reaktif.
Jika
ditinjau dari segi regangan cincinnya, yang dihitung berdasarkan harga kalor
pembakaran, terbukti bahwa harga regangan total cincin yang terbesar adalah
pada siklopropana, disusul dengan siklobutana, dan siklopentana. Pada
sikloheksana harganya = 0, yang sama dengan harga senyawa rantai terbuka.
Besarnya harga regangan pada siklopropana tersebut disebabkan oleh adanya
regangan sudut dan regangan sterik. Makin besar penyimpangannya dari sudut
tetrahedral, makin besar pula regangan sudutnya.
Dalam
usaha mengurangi regangan agar diperoleh kestabilan, molekul sikloalkana
mengalami konformasi. Pada siklopentana konformasinya mengakibatkan keempat
atom karbonnya berada dalam satu bidang dan atom karbon kelima membentuk ikatan
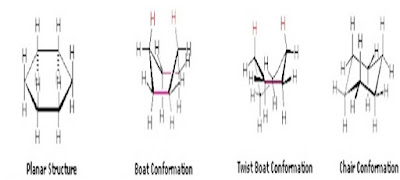
bengkok. Pada sikloheksana konformasinya mengakibatkan semua ikatan C-C-C
mempunyai sudut 109,50. Salah satu dari konformasi pada sikloheksana
dinamakan konformasi kursi, yang ditandai oleh adanya dua macam orientasi
ikatan C-H, yaitu enam buah ikatan C-H aksial dan enam buah ikatan C-H
ekuatorial. Dikenal pula adanya konformasi perahu pada sikloheksana, yang
kestabilannya lebih rendah daripada konformasi kursi. Jika satu atom H pada
sikloheksana diganti oleh gugus –CH3 atau gugus lain, maka gugus –CH3/
gugus lain tersebut dapat berposisi aksial/ ekuatorial. Dalam hal ini
konformasi yang lebih stabil adalah konformasi dengan gugus –CH3
berposisi ekuatorial.
Bila
sikloalkana mengikat substituen pada dua atau lebih atom karbon, maka terjadi
isomer cis-trans. Salah satu contohnya adalah pada 1,2-dimetilsiklopentana.
Dalam penggambaran strukturnya, cincin siklopentana digambarkan sebagai
segilima datar, dengan ketentuan bila kedua substituennya terletak pada sisi
yang sama dari bidang cincin dinamakan isomer cis, sedangkan bila berseberangan
dengan bidang cincin dinamakan isomer trans. Pada sikloheksana juga dijumpai
isomer-isomer cis-tans, yang bila digambarkan dengan konformasi kursi, yang
masing-masing substituen dapat berposisi aksial atau ekuatorial. Sifat-sifat
fisika dan kimia sikloalkana hampir sama dengan alkana, yaitu nonpolar, titik
didih dan titik leburnya sebanding dengan berat molekulnya, dan inert (lambat
bereaksi dengan senyawa lain). Reaksi sikloalkana dengan oksigen dapat
menghasilkan CO2 dan H2O, sedangkan dengan halogen
terhadi reaksi substitusi atom H oleh atom halogen. Khusus untuk siklopropana
dan siklobutana, dengan kondisi reaksi khusus, dapat mengalami pemutusan
cincin.
Di
alam, sikloalkana terkandung dalam minyak bumi bersama-sama dengan alkana.
Kandungan sikloalkana dalam minyak bumi berkaitan erat dengan tempat
mendapatkannya minyak bumi tersebut. Sebagai contoh, minyak bumi yang berasal
dari California banyak mengandung sikloalkana. Dalam industri minyak bumi,
sikloalkana dikenal dengan nama naftalena.
Untuk
membuat sikloalkana, dapat digunakan bahan dasar senyawa alifatik, atau senyawa
aromatik. Sebagai contoh, siklopropana dibuat dengan reaksi Freud, yaitu dengan
mereaksikan 1,3-dibromopropana dengan logam seng. Untuk membuat sikloheksana
dapat ditempuh dengan cara hidrogenasi benzena dengan katalis Ni, pada suhu dan
tekanan tinggi.
- Makin besar penyimpangannya terhadap sudut ikatan tetrahedral, molekulnya makin regang, dan berakibat molekul tersebut makin reaktif.
- Sikoalkana memiliki kereaktifan yang sangat mirip dengan alkana, kecuali untuk sikloalkana yang sangat kecil – khususnya siklopropana.
 | |
Siklopropana
Besarnya harga regangan pada siklopropana tersebut
disebabkan oleh adanya regangan sudut dan regangan sterik. Makin besar
penyimpangannya dari sudut tetrahedral, makin besar pula regangan sudutnya.
– Sudut ikatan CCC di siklopropana (60 o)
yang jauh berbeda dari sudut ikatan ideal 109,5 o .
– Sudut ikatan ini menyebabkan
siklopropana memiliki strain cincin yang tinggi.
– Molekul seperti sikloheksana dan
siklopentana, akan memiliki regangan cincin jauh lebih rendah karena sudut
ikatan antara karbon lebih dekat ke 109,5 o.
CINCIN REGANGAN DISIKLOALKANA
Dalam usaha mengurangi regangan agar diperoleh kestabilan, molekul sikloalkana mengalami konformasi.
KONFORMASI SIKLOALKANA
KONFORMASI SIKLOHEKSANA
Salah
satu dari konformasi pada sikloheksana dinamakan konformasi kursi, yang
ditandai oleh adanya dua macam orientasi ikatan C-H, yaitu enam buah ikatan C-H
aksial dan enam buah ikatan C-H ekuatorial.
Mutirakhela.2013.SenyawaHidrokarbon.(Online).
http://zulfamutyrakhela.blogspot.co.id/.
Diakses 12 November 2016 pukul 21.01 WIB.
http://slideplayer.info/slide/3015583/. Diakses 10 November 2016
pukul 11.41 WIB.
https://isepmalik.wordpress.com/2012/04/21/sikloalkana/. Diakses
12 November 2016 pukul 21.51 WIB.
http://diannafisah27.blogspot.co.id/2016/10/v-behaviorurldefaultvmlo.html.
Diakses 11 November 2016 pukul 19.31 WIB.
TERIMAKASIH SEMOGA BERMANFAAT :) |





Terima kasih atas pemaparannya,saya mau tanya mengapa pada sikloheksana harganya 0?
BalasHapusBaiklah, terimakasih saudara putri atas pertanyaannya. Besarnya harga regangan pada sikloheksana tersebut disebabkan oleh adanya regangan sudut dan regangan sterik. Makin besar penyimpangannya dari sudut tetrahedral, makin besar pula regangan sudutnya. Sehingga pada siklohrksana harganya 0.
HapusTerimakasih, semoga bermanfaat :)
terimakasih atas materinya, saya ingin bertanya apa yang terjadi apabila sudut ikatan semakin besar ?
BalasHapusBaiklah, terimakasih saudari henty. Apabila seMakin besar penyimpangan dari sudut ikatan tetrahedal maka akan semakin besar ragangannya, yang berakibat makin reaktif pula.
HapusTerimakasih, semoga bermanfaat 😊
Terimakasih atas pemaparan materinya, sangat bermanfaat. Saya ingin bertanya bagaimana regangan ruang pada nonsiklik dan contohny? Terimaksih
BalasHapusbaiklah terima kasih atas pertanyaan saudari putri.
Hapusumtuk regangan ruang pada non siklik, contohnya pada propana dimana gugus-gugus yang terikat oleh ikatan sigma dapat berotasi mengelilingi ikata itu. oleh karena itu atom-atom dalam suatu molekul rantai terbuka dapat memiliki tak terhingga banyak posisi didalam ruang relatif satu terhadap yang lain. sehingga terjadi konformasi untuk menjaga kestabilannya.
terima kasih, semoga pertanyaan saudari dapat terjawab dan semoga bermanfaat :)
Terimakasih atas pemaparan materinya, sangat bermanfaat. Saya ingin bertanya bagaimana regangan ruang pada nonsiklik dan contohny? Terimaksih
BalasHapusMateri yang anda sajikan sudah cukup jelas, namun saya ingin bertanya mengapa siklopentana memiliki regangan cincin yang lebih besar dari siklo yg lain?
BalasHapusbaiklah, terima kasih saudari riska atas pertanyaannya. perlu diingat bahwa regangan cincin yang lebih besar terdapat pada siklopropana bukan pada siklopentana. hal ini ditinjau dari segi regangan cincinnya, yang dihitung berdasarkan harga kalor pembakaran, terbukti bahwa harga regangan total cincin yang terbesar adalah pada siklopropana, disusul dengan siklobutana, dan siklopentana. Pada sikloheksana harganya = 0, yang sama dengan harga senyawa rantai terbuka. Besarnya harga regangan pada siklopropana tersebut disebabkan oleh adanya regangan sudut dan regangan sterik. Makin besar penyimpangannya dari sudut tetrahedral, makin besar pula regangan sudutnya.
Hapusterima kasih semoga dapat menjawab pertanyaan saudari. semoga bermanfaat :)
Terimakasih atas informasi nya, sangat bermanfaat
BalasHapusterima kasih :)
Hapusterima kasih atas materi yang anda sajikan sudah cukup jelas dan dapat dimengerti, namun saya ingin bertanya mengapa konformasi pada sikloheksana dinamakan konformasi kursi? dapatkan berubah menjadi konformasi yang lainnya?
BalasHapusterima kasih saudari najlia atas pertanyaannya. Pada sikloheksana konformasinya mengakibatkan semua ikatan C-C-C mempunyai sudut 109,50. Salah satu dari konformasi pada sikloheksana dinamakan konformasi kursi, yang ditandai oleh adanya dua macam orientasi ikatan C-H, yaitu enam buah ikatan C-H aksial dan enam buah ikatan C-H ekuatorial. Dikenal pula adanya konformasi perahu pada sikloheksana, yang kestabilannya lebih rendah daripada konformasi kursi. Jika satu atom H pada sikloheksana diganti oleh gugus –CH3 atau gugus lain, maka gugus –CH3/ gugus lain tersebut dapat berposisi aksial/ ekuatorial. Dalam hal ini konformasi yang lebih stabil adalah konformasi dengan gugus –CH3 berposisi ekuatorial.konformasi dapat berubah dikarenkan untuk menjaga kestabilan dari senyawa tersebut
Hapussemoga dapat menjawab atas pertanyaan saudari
terima kasih semoga bermanfaat :)
Apakah regangan ruang hanya terjadi pada senyawa hidrokarbon? Mohon contohnya yang molekul non hidro karbon.
BalasHapusbaiklah saudara firdaus, terima kasih atas pertanyaan saudara.
Hapusyang saya ketahui, regangan ruang hanya terjadi pada senyawa hidrokarbon, siklik maupun non siklik. untuk senyawa non hidrokarbon ada kemungkinan bisa juga, namun akan saya pelajari lebih lanjut.
semoga dapat membantu menjawab pertanyaan saudara
terima kasih semoga bermanfaat :)
Trimakasih saudari rani atas pemaparannya yang sangat lengkap, semoga bermanfaat yaa
BalasHapusSama-sama saudari nevira, terima lasih telah berkunjung ke blog saya. Semoga bermanfaat :)
Hapus